已知kahac=1.76目录
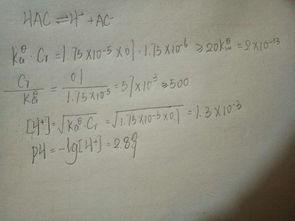
PH=-㏒[H]碱Cb=0.1
[H]=√Ka×Ca得Ca=5.7混合后:
PH=PKa ㏒[Ac]\[HAc][Ac]=Cb×V\2V=0.05[HAc]=0.5×Ca-[Ac]=2.8所以PH=4.513望采纳,。
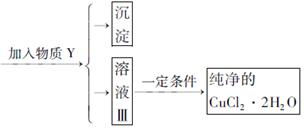
若按照HAc的Ka=1.76*10^-5来计算:
Ac- H2O
已知kahac=1.76目录
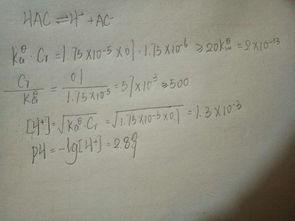
PH=-㏒[H]碱Cb=0.1
[H]=√Ka×Ca得Ca=5.7混合后:
PH=PKa ㏒[Ac]\[HAc][Ac]=Cb×V\2V=0.05[HAc]=0.5×Ca-[Ac]=2.8所以PH=4.513望采纳,。

若按照HAc的Ka=1.76*10^-5来计算:
Ac- H2O
◎欢迎参与讨论,请在这里发表您的看法、交流您的观点。